近日,重庆药监局发布《关于印发《重庆市“两品一械”企业质量安全主体责任清单》的通知》。
该《清单》基本涵盖从实验室到医院的全生命周期监管主体对象,具体划分为22类主体责任清单,包括3类研究机构(药物临床试验机构、药物非临床安全性评价研究机构、医疗器械临床试验机构)、6类生产企业〔药品上市许可持有人(药品生产企业)、中药饮片生产企业(含中药配方颗粒)、医疗器械注册人备案人、医疗器械委托生产企业、化妆品注册人备案人(委托生产)、化妆品注册人备案人(自主生产)〕、4类批发企业及互联网销售第三方平台(药品批发企业、药品零售连锁总部、药品网络交易第三方平台、医疗器械互联网销售第三方平台)、9类经营使用单位(药品零售企业、医疗器械经营企业、药品使用单位、医疗器械使用单位、化妆品经营者、化妆品电子商务平台经营者、电子商务平台内化妆品经营者、化妆品集中交易市场开办者和展销会举办者,以及美容美发机构、宾馆等化妆品经营使用单位)。
各类清单内容主要涵盖对应主体的注册、许可、备案等资质条件,研究管理、生产经营和使用质量管理、文件制度管理等责任内容,研制生产经营和使用的产品和物料所涉及的标准、标签说明书、检验、放行、进货查验、储存养护、配送、追溯、监测评价、召回等管理责任,企业相关的组织机构和人员管理、设施设备管理等责任内容,以及特殊药品、第三平台入驻经营者管理、广告宣传和价格等其他有特别管理要求的责任和义务内容。
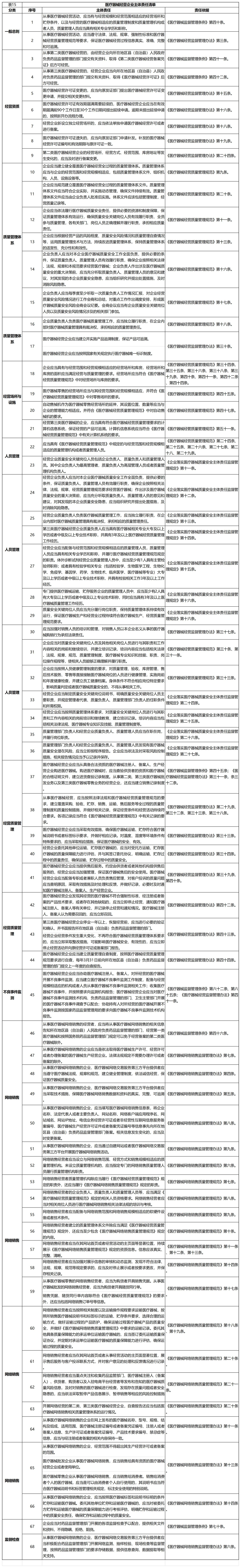
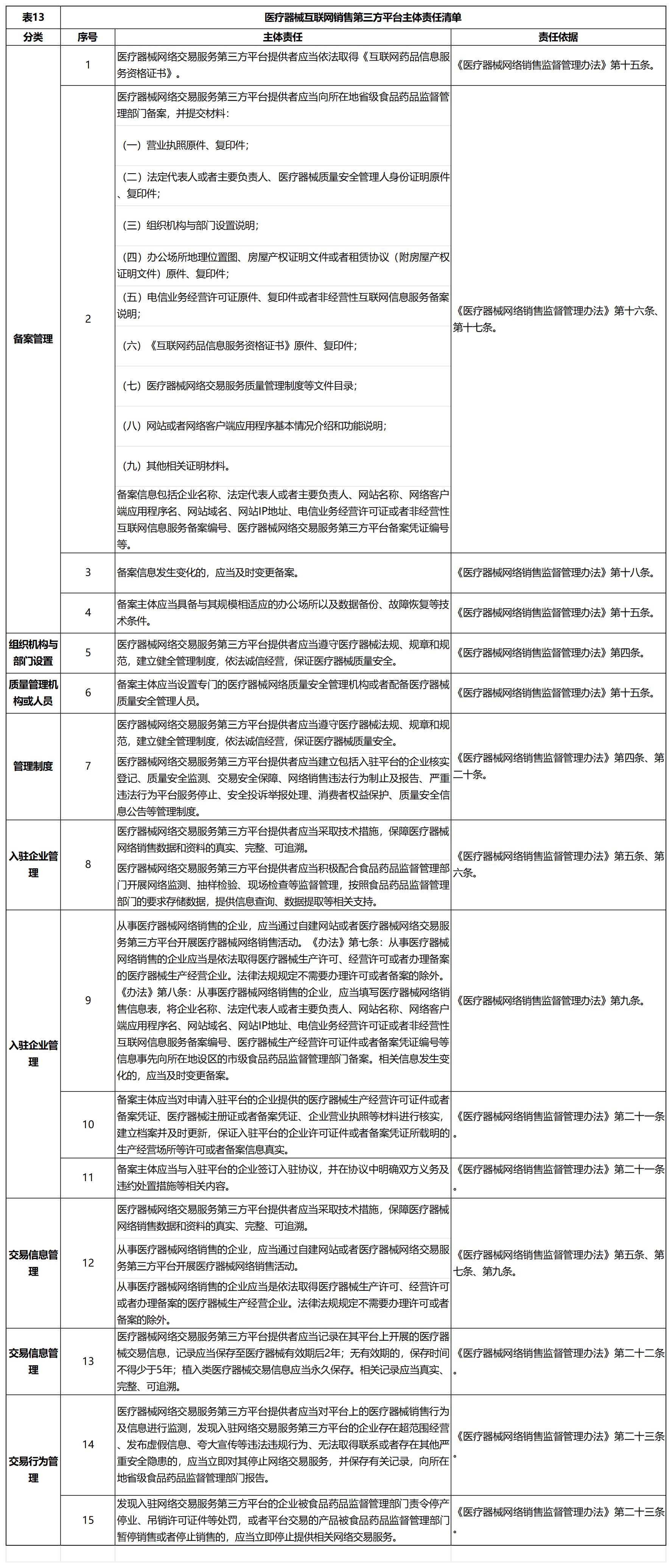
小编在这里专门摘录出来涉及医疗器械经营企业相关,共3个清单,分别是《医疗器械经营企业主体责任清单》、《医疗器械互联网销售第三方平台主体责任清单》、《医疗器械注册人、备案人主体责任清单》。这三个《清单》是以《医疗器械监督管理条例》、《医疗器械注册与备案管理办法》、《企业落实医疗器械质量安全主体责任监督管理规定》、《医疗器械经营监督管理办法》、《医疗器械不良事件监测和再评价管理办法》、《医疗器械召回管理办法》、《医疗器械网络销售监督管理办法》、《医疗器械网络销售质量管理规范》、《医疗器械经营质量管理规范》、《企业落实医疗器械质量安全主体责任监督管理规定》等,做为法律依据。
原文如下:
有关单位,各区县(自治县)市场监管局,两江新区、重庆高新区、万盛经开区市场监管局,局属各检查局、市食药检院、市药审中心、市药品监测中心、重庆器械检验中心,局机关相关处室:
为进一步完善药品安全责任体系,推动药品、医疗器械、化妆品质量安全主体责任落实,切实保障全生命周期质量安全,现印发《重庆市“两品一械”企业质量安全主体责任清单》,请遵照执行。
重庆市药品监督管理局
2025年10月31日

原文链接:
重庆市药品监督管理局关于印发《重庆市“两品一械”企业质量安全主体责任清单》的通知渝药监〔2025〕19号