2023年1月1日起,《国家药监局综合司关于加强医疗器械生产经营分级监管工作的指导意见》(以下简称《指导意见》)开始施行。
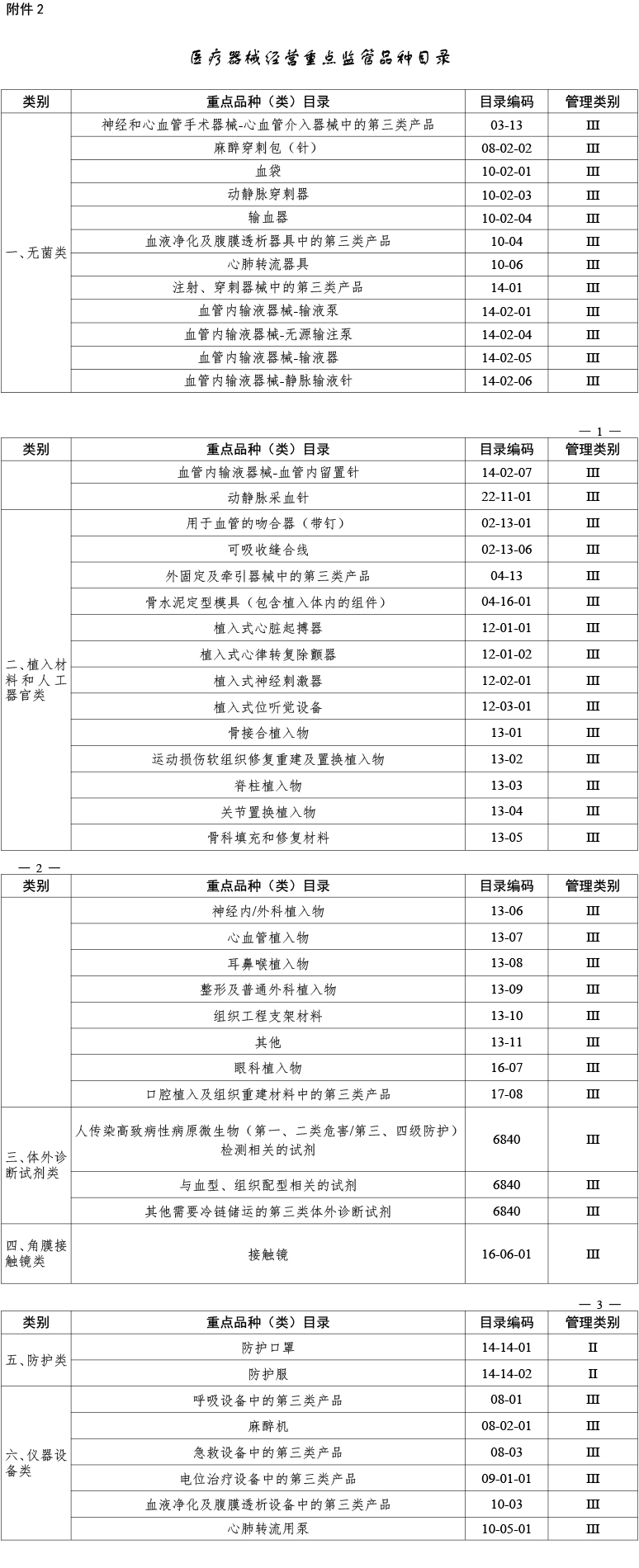
文件将指导各地药品监管部门在医疗器械注册人制度下开展医疗器械生产经营监管工作。国家药监局同时发布了《医疗器械生产重点监管品种目录》和《医疗器械经营重点监管品种目录》(附文末)。

特别注意的是 ,文件提出了对医疗器械生产经营企业的监管级别划分原则和检查要求,药品监管部门可以按照风险将医疗器械企业划分为四个监管级别,对不同监管级别的企业实施相应监管措施。
下面着重介绍,经营端。
国家药监局强调,将落实经营分级监管职责。
国家药品监督管理局负责指导和检查全国医疗器械经营分级监管工作,并制定医疗器械经营重点监管品种目录;省、自治区、直辖市药品监督管理部门负责指导和检查设区的市级负责药品监督管理的部门实施医疗器械经营分级监管工作;设区的市级负责药品监督管理的部门负责制定本行政区域医疗器械经营重点监管品种目录,组织实施医疗器械经营分级监管工作;县级负责药品监督管理的部门负责本行政区域内医疗器械经营分级监管具体工作。
对于跨设区的市增设库房的医疗器械经营企业,按照属地管理原则,由经营企业和仓库所在地设区的市级负责药品监督管理的部门分别负责确定其监管级别并实施监管工作。
结合实际确定重点监管品种目录。
国家药品监督管理局根据医疗器械产品和产品经营风险程度,制定并动态调整医疗器械经营重点监管品种目录(见文末附件);设区的市级负责药品监督管理的部门应当综合分析产品监督抽验、不良事件监测、产品召回、质量投诉、风险会商情况等因素,对国家药品监督管理局制定的目录进行补充,确定本行政区域医疗器械经营重点监管品种目录并进行动态调整。
对于跨设区的市增设库房的医疗器械经营企业,由库房所在地设区的市级负责药品监督管理的部门负责确定其库存的产品是否属于本行政区域医疗器械经营重点监管产品。
设区的市级负责药品监督管理的部门应当根据本行政区域医疗器械经营的风险程度、经营业态、质量管理水平和企业监管信用情况,结合医疗器械不良事件及产品投诉状况等因素,制定并印发分级监管细化规定,明确监管级别划分原则,以及对不同监管级别医疗器械经营企业的监督检查形式、频次和覆盖率。
监管级别划分和检查要求按照以下原则进行:
对风险程度高的企业实施四级监管,主要包括“为其他医疗器械注册人、备案人和生产经营企业专门提供贮存、运输服务的”经营企业和风险会商确定的重点检查企业;
对风险程度较高的企业实施三级监管,主要包括本行政区域医疗器械经营重点监管品种目录产品涉及的批发企业,上年度存在行政处罚或者存在不良监管信用记录的经营企业;
对风险程度一般的企业实施二级监管,主要包括除三级、四级监管以外的经营第二、三类医疗器械的批发企业,本行政区域医疗器械经营重点监管品种目录产品涉及的零售企业;
对风险程度较低的企业实施一级监管,主要包括除二、三、四级监管以外的其他医疗器械经营企业。
涉及多个监管级别的,按最高级别对其进行监管。
实施四级监管的企业,设区的市级负责药品监督管理的部门每年组织全项目检查不少于一次;实施三级监管的企业,设区的市级负责药品监督管理的部门每年组织检查不少于一次,其中每两年全项目检查不少于一次;实施二级监管的企业,县级负责药品监督管理的部门每两年组织检查不少于一次,对角膜接触镜类和防护类产品零售企业可以根据监管需要确定检查频次;
实施一级监管的企业,县级负责药品监督管理的部门按照有关要求,每年随机抽取本行政区域25%以上的企业进行监督检查,4年内达到全覆盖。必要时,对新增经营业态的企业进行现场核查。
全项目检查是指药品监督管理部门按照医疗器械经营质量管理规范及相应附录,对经营企业开展的覆盖全部适用项目的检查。对“为其他医疗器械注册人、备案人和生产经营企业专门提供贮存、运输服务的”经营企业开展的全项目检查,应当包括对委托的经营企业的抽查。
动态调整监管级别。设区的市级负责药品监督管理的部门应当根据医疗器械经营分级监管细化规定,在全面有效归集医疗器械产品、企业和监管等信息的基础上,每年组织对本行政区域医疗器械经营企业、跨设区的市增设库房的医疗器械经营企业进行评估,科学研判企业风险程度,确定监管级别并告知企业。对于新增经营业态等特殊情况可以即时确定或调整企业监管级别。
对于长期以来监管信用情况较好的企业,可以酌情下调监管级别;对于存在严重违法违规行为、异地增设库房、国家集中带量采购中选产品和疫情防控用产品经营企业应当酌情上调监管级别。具体调整方式由设区的市级负责药品监管的部门结合本行政区域企业整体监管信用状况、企业数量和监管资源配比等情况确定。
根据监管级别强化监督检查。地方各级负责药品监督管理的部门应当根据监管级别,制定年度监督检查计划,明确检查重点、检查方式、检查频次和覆盖率。检查方式原则上应当采取突击性监督检查,鼓励采用现代信息技术手段实施监督管理,提高监管效率和水平。
备注:本指导意见施行后。原国家食品药品监督管理总局《关于印发〈医疗器械生产企业分类分级监督管理规定〉的通知》(食药监械监〔2014〕234号)、《关于印发国家重点监管医疗器械目录的通知》(食药监械监〔2014〕235号)、《关于印发〈医疗器械经营企业分类分级监督管理规定〉的通知》(食药监械监〔2015〕158号)和《医疗器械经营环节重点监管目录及现场检查重点内容》(食药监械监〔2015〕159号)同时废止。